Для чего назначают УЗИ артерий нижних конечностей (часть 2)
Дуплексное ультразвуковое наблюдение после ангиопластики нижних конечностей показало стеноз по диаметру> 50% в 20–40% обработанных конечностей в течение 12 месяцев после процедуры. Наиболее частая этиология - развитие миоинтимальной гиперплазии в области ангиопластики независимо от используемой эндоваскулярной терапии (надувание баллона, ангиопластика и стентирование и атерэктомия). Обнаружение> 50% остаточного стеноза несмотря на то, что селективная ангиограмма, показывающая адекватное расширение просвета (<30% диаметра), может иметь место, позволяет прогнозировать ангиопластику и является основанием для проведения интра- или раннего (<30 дней) постпроцедурного исследования. Распространенность при дуплексном сканировании остаточного стеноза после ангиопластики ниже бедренно-подколенного сегмента после ангиопластики или имплантации стента (<5%) и выше бедренно-подколенного сегмента после баллонной ангиопластики (от 15% до 20%) или атерэктомии (25%). В то время как ангиопластика под контролем ангиограммы, показывающая остаточный стеноз от <20% до 30%, предсказывает 30-дневную проходимость, то есть технический успех, дуплексное ультразвуковое исследование гемодинамики в месте ангиопластики обеспечивает более точную оценку функциональной проходимости. Было документально подтверждено, что выявленный дуплексным сканированием стеноз> 50% после баллонной ангиопластики развивался чаще, чем после стентирования при лечении окклюзионного поражения поверхностной бедренной артерии как через 6 (45% против 25%, p = 0,06), так и через 12 месяцев (63% против 37%, p <0,05). Другие методы, также имеют высокий технический успех, но аналогично баллонной ангиопластике, рестеноз или тромбоз в месте лечения наблюдались в 20–50% конечностей в зависимости от тяжести поражения к 1 году.
УЗИ артерий после вмешательств
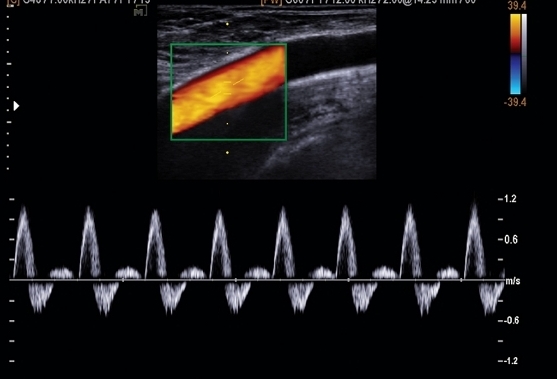
Исследование периферических артерий после чрескожной транслюминальной ангиопластики (ЧТА) включает интерпретацию давления в конечностях и результаты дуплексного ультразвукового сканирования. Интерпретация должна указывать на тяжесть ишемии конечностей (легкая, умеренная или тяжелая), отклонения от значений до вмешательства, а также у пациентов, получавших сосудистое лечение, была ли достигнута адекватная перфузия стопы, то есть давление в пальцах стопы> 30 мм рт. Результаты дуплексного УЗИ в месте ангиопластики интерпретируются как отсутствие стеноза (стеноз <50% диаметра), умеренный стеноз (> 50% диаметра), тяжелый стеноз (> 70% диаметра) или окклюзия.
Интерпретация «нормального исследования» должна указывать на то, что стеноза в месте ангиопластики нет, и что лодыжечно-плечевой индекс (ЛПИ) в норме или не изменился, если было проведено предварительное тестирование. Дуплексное ультразвуковое сканирование обнаруживает стеноза> 50% по диаметру проксимальнее, внутри или дистальнее эндоваскулярного вмешательства интерпретируется как «новое» отклонение от нормы. Критерии скорости, используемые для интерпретации степени стеноза периферических артерий, основаны в первую очередь на измерениях пиковой систолической скорости (ПСС) и Vr при стенозе. Хотя обычно считается, что Vr> 2 указывает на стеноз по диаметру> 50%, эта интерпретация также должна быть связана с результатами дуплексного ультразвукового исследования: уменьшение просвета, цветная допплеровская визуализация нарушенного кровотока и очаговое увеличение ПСС до> 180 смс. В условиях покоя стеноз с Vr от 2 до 3 связан с минимальным градиентом систолического давления в состоянии покоя, а спектры скорости артерии голеностопного сустава могут демонстрировать "почти нормальную" многофазную форму волны. Функциональное значение стеноза можно определить с помощью нагрузочного теста с измерением изменения ЛПИ и давления в голеностопном суставе. Опубликованные дуплексные критерии для классификации места ангиопластики рекомендуют использовать три категории заболеваний (стеноз <50%, стеноз> 70% и окклюзия). В сосудистой группе мы используем комбинированный подход и пороговые критерии ПСС более 300 см/с и Vr 3.5, соответственно, для определения стеноза по диаметру> 70%. Группа Университета Питтсбурга сообщила о ПСС с > 95% при прогнозировании> 50% или> 80% стеноза внутри стента после бедренно-подколенной ангиопластики при поражениях TASC B и C. У пациентов с развившимися симптомами рецидивной ишемии конечностей и снижением ЛПИ> 0,15 стеноз в месте ангиопластики имел среднее значение ПСС max = 360 см / с и Vr = 3,6 - критерии стеноза по диаметру> 70% в обеих классификационных схемах.
Наличие расслоения бляшки после баллонной дилатации, геометрия стента и характер развития миоинтимальной гиперплазии могут повлиять на значимость повышения ПСС и, следовательно, на точность прогнозирования тяжести стеноза. В целом значения ПСС для классификации стеноза в стенте выше, чем для атеросклеротического стеноза de novo, где значение> 125–150 см / сек является «приемлемым» порогом для стеноза> 50%. Ангиопластика со стентированием снижает податливость стенки артерии, что увеличивает ПСС внутри стента и вызывает аномальное, неоднородное напряжение сдвига стенки в конечных точках стента, что усиливает развитие миоинтимальной гиперплазии. В сосудистой группе мы используем одни и те же критерии интерпретации для классификации стеноза шунта артерии нижних конечностей и стеноза в месте ангиопластики, включая пороговые критерии для повторного вмешательства (ПСС> 300 см / с, Vr> 3,5).
Неудача ангиопластики на УЗИ артерий может проявляться окклюзией, диффузным или множественным стенозом или очаговым стенозом высокой степени. Результаты дуплексного ультразвукового исследования диффузного стеноза в стенте включают уменьшение просвета при энергетическом допплеровском исследовании и повышенные (от 200 до 300 см/с) значения ПСС по всей длине стента. Снижение ЛПИ может быть аналогично фокальному стенозу высокой степени с ПСС> 400 см / с и КДС> 100 см/с. Важным гемодинамическим признаком неудачи ангиопластики является наличие затухающей, низкоскоростной формы волны спектра в дистальном артериальном дереве.
Протокол наблюдения на дуплексном сканировании артерий после вмешательств
У здорового с медицинской точки зрения пациента следует рассмотреть возможность восстановления с применением ангиопластики выявленного дуплексным сканированием стеноза> 70%. Частота неэффективности эндоваскулярного вмешательства наиболее высока в течение первых 6 месяцев, особенно если выявлен остаточный стеноз (ПСС> 180 см / с, Vr от 1,5 до 2,5}. Основанием для контрольного тестирования является выявление «неэффективных» участков ЧТА до возникновения тромбоза. Неудача ангиопластики обычно является результатом миоинтимальной гиперплазии, развивающейся внутри или в непосредственной близости от места лечения, также перелом стента - известный риск. Фактор развития стеноза и тромбоза не может быть идентифицирован с помощью дуплексного ультразвукового исследования, но наличие деформации или изгиба стента является аномальным и прогнозирует тромбоз стента, особенно если он связан со стенозом> 70%.
Стандарты отчетности о клиническом улучшении и проходимости артерии после процедуры эндоваскулярной терапии идентичны «открытой» хирургической пластике или шунтированию. Проходимость места вмешательства, подтвержденная дуплексным ультразвуковым сканированием, и увеличение ЛПИ> 0,15 являются минимальными критериями исхода для клинического улучшения. Клинический успех требует устранения симптомов или признаков ишемии конечностей, а также стеноза восстановления артерии <50%, подтвержденного дуплексным ультразвуковым сканированием или ангиографией. Обнаруженный на УЗИ артерий стеноз> 50% по диаметру, основанный на данных скоростных спектров, является ненормальным обнаружением, и если стеноз прогрессирует до> 70% по диаметру, это критерий значимой потери проходимости артерии, независимо от того, была ли она восстановлена или выбран для наблюдения после выписки из больницы бессимптомный больной. Открытое или чрескожное вторичное вмешательство, предпринимаемое для поддержания или улучшения функциональной ангиопластики, изменяет исход процедуры на «вспомогательную» первичную проходимость. Если место ангиопластики тромбировано и для восстановления проходимости выполняется вторичная процедура, статус результата меняется на «вторичную» проходимость. Успешная программа эпиднадзора после ЧТА должна обеспечить вспомогательную первичную проходимость в диапазоне от 80% до 90% через 2 года без значительного нарушения вторичной проходимости. Неспособность идентифицировать клинически значимые поражения до тромбоза присутствует, если показатели первичной и вспомогательной первичной проходимости схожи.
Отклонение от нормы или изменение ЛПИ указывает на ЗПА, но не является диагностическим признаком недостаточности участка ангиопластики. У многих пациентов с диабетом измерение ЛПИ неточно, а исследование артерий конечностей требует регистрации пульсового объема и дуплексного ультразвукового исследования для оценки перфузии конечностей и функциональной проходимости после ЧТА. Применение объективных критериев, обеспечиваемых дуплексным ультразвуковым сканированием, необходимо для полезной программы наблюдения. Использование комбинированных пороговых критериев для вмешательства, то есть PSV> 300 см/с, Vr> 3,5, связано с высокой прогностической ценностью по сравнению с результатами ангиограммы для стеноза по диаметру> 70%. После протезного шунтирования или имплантации стента, ПСС <40-50 см/с является важным результатом теста, поскольку низкая скорость трансплантата считается предиктором тромбоза трансплантата.
Первичный контрольный осмотр следует провести в течение 2 недель, что идеально сочетается с амбулаторной оценкой сосудистой клиники для оценки уровня активности пациента, модификаций факторов риска и обзора медикаментозной (антиагреганты и статины) терапии. Если первоначальное тестирование является нормальным, последующее тестирование через 3 месяца подходит для пациентов, получавших лечение по поводу ишемии конечности, и через 6 месяцев у пациентов с хромотой. Последующее тестирование проводится индивидуально с интервалами от 6 до 12 месяцев. Если первоначальное дуплексное ультразвуковое исследование обнаруживает остаточный стеноз в месте ангиопластики от 50% до 70%, повторное обследование через 4–6 недель рекомендуется и показано для выявления прогрессирования стеноза. Пациента следует проинструктировать о том, что любые новые симптомы ишемии конечности следует немедленно оценивать в сосудистой клинике. Сокращенные интервалы тестирования, то есть 3 месяца, также могут быть подходящими в течение первого года после эндоваскулярного лечения поражений TASC C и D из-за более высокой вероятности неудачи. Частота повторного вмешательства выше после баллоной ангиопластики (30%), чем после стентирования (20%), а баллонная ангиопластика и стентирование с лекарственным покрытием еще больше снижают вероятность развития стеноза.
Выводы
- Применение дуплексного ультразвукового сканирования для наблюдения после вмешательства на периферических артериях может быть полезным и должно рассматриваться как часть лечения пациентов с ЗПА.
- Ненадежно полагаться на то, что у пациента распознается изменения перфузии конечностей.
- Интерпретация артериальных исследований, выполненных в рамках протокола наблюдения, может быть сложной задачей, и некоторые сосудистые специалисты не уверены, что рутинное дуплексное ультразвуковое наблюдение приносит пользу, стоит затрат на здравоохранение, или убеждены, что сосудистое исследование компетентно для выполнения программы контроля качества.
- Дуплексное ультразвуковое наблюдение при правильном выполнении и интерпретации должно улучшить проходимость и клинические результаты после шунтирования нижних конечностей и эндоваскулярных терапевтических вмешательств с известной ограниченной функциональной проходимостью и выполняемых в когорте пациентов с прогрессированием болезни периферических артерий.
- Было показано, что при дуплексном сканировании эндоваскулярные вмешательства на артериальных стенозах приводят к такой же проходимости, как и у трансплантатов, не находящихся под угрозой окклюзии.